قانون پایستگی جرم چیست + فیلم آموزش فیزیک

قانون پایستگی جرم یکی از قوانین بسیار ساده و در عین حال مهم در جهان است و در تمام علوم مانند شیمی ، فیزیک، مکانیک سیالات و… از آن استفاده میشود. این قانون به قانون بقا نیز معروف است و در اصطلاع انگلیسی با عنوان Conservation of mass از آن یاد می کنند. قانون فوق در تمامی دوره های تحصیلی در مدرسه و دانشگاه آموزش داده میشود و دارای قوانین و فرمولهای خاص خود میباشد. به همین منظور در این محتوا توضیحات اولیه پیرامون این قانون را برایتان شرح می دهیم، برای اطلاعات بیشتر یا مشاهده ویدیوهای آموزشی و حل نمونه سوال می توانید از آموزش های منتشر شده در فرادرس کمک بگیرید.
تاریخچه قانون پایستگی جرم
این قانون در ابتدا بر اساس یک نظریه در یونان باستان بیان شد و جرقه آغازینش این تفکر بود که هیچ ماده یا جزئی در جهان وجود ندارد که خود به خود به وجود آمده باشد. این نظریه سال ها بدون بررسی باقی ماند، چرا که تبدیل مواد به گاز و عدم توانایی برای مشاهده یا اندازه گیری وزن آن ها سبب شد تا دانشمندان توجه درستی به نظریه مطرح شده نکنند. با گذشت سال های طولانی دوباره ایده هایی مشابه با این نظریه بیان شد و مورد بررسی و پرورش دقیق تر قرار گرفت، تا جایی که در سدههای بعدی نظریههای مشابهی با عنوان ” به وجود آمدن از نیستی غیر ممکن است” یا “کمیت مواد همیشه به یک میزان بوده و در آن تغییری ایجاد نمیشود” توسط بسیاری از دانشمندان و پژوهشگران بیان شد.
این نظریات و بیانیه ها همچنان پابرجا ماند تا اینکه در سال ۱۷۸۹ شیمیدانی به نام آنتوان لاووازیه قانون بقای جرم را بیان کرد. طبق این قانون یک ماده در واکنشهای شیمیایی به وجود نیامده و از بین نمیرود، بلکه تنها از حالتی به حالت دیگر تبدیل میشود.
توضیح قانون پایستگی جرم با چند مثال ساده
همانطور که گفتیم این قانون توسط یک شیمیدان بیان شد و طبق آن مجموع جرم مواد در جهان هستی برابر بوده و تنها طی واکنش های شیمیایی شاهد تغییر حالت و تبدیل اتم ها به یکدیگر هستیم. حال با چند مثال ساده پایستگی جرم را با زبانی ساده تر بیان میکنیم .
مثال اول:
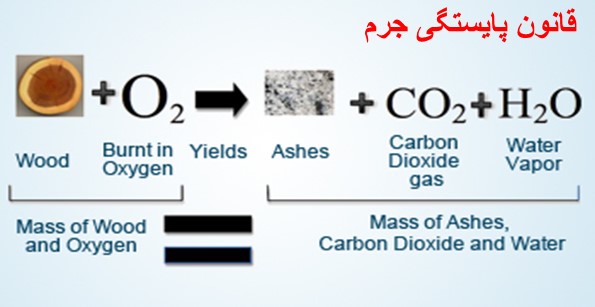
در نظر بگیرید که یک ماده در حال سوختن است، به عنوان مثال قطعه چوب را به همراه آتش میسوزانیم. اگر پیش از سوزاندن قطعه چوب آن را وزن کنیم و وزن خاکستر آن را بعد از اتمام مراحل سوختن اندازه بگیریم، ممکن است تصور کنیم که قطعه ای از چوب ناپدید شده است، چراکه وزن اولیه با وزن ثانویه برابر نیست!
حال اگر این مراحل سوختن را در یک محیط بسته و ایزوله انجام دهیم و وزن چوب اولیه در محیط بسته اولیه و وزن خاکستر آن را در محیط بسته ثانویه اندازه بگیریم،مشاهده میکنیم که وزن دو محیط برابر است. دلیل آن هم پیروی از قانون بقا جرم بوده که در هنگام سوختن مولکولهای چوب به همراه گاز اکسیژن واکنش داده و ترکیب گازی دی اکسید کربن را تولید میکنند. به همین منظور پس از اتمام مراحل سوختن ما تنها خاکستر آن را میبینیم و مولکول های گازی از دید ما پنهان می مانند. از جمله این مولکول ها می توان به اکسیژن گازی واکنش دهنده، ترکیب اکسیژن با عنصر کربن موجود در چوب و تبدیل به کربن دی اکسید گازی، ترکیب اکسیژن با هیدروژن موجود و تبدیل به بخار آب و… اشاره داشت که گاز های کربن دی اکسید و اکسیژن و بخار آب و… از سطح ماده خارج میشوند.
اگر بتوان وزن کربن دی اکسید و اکسیژن دیگر گازهای خارج شده را اندازه گرفت، به این نتیجه میرسیم که دقیقاً مجموع جرم تکه چوب و اکسیژن با مجموع جرم خاکستر و گازهای پدید آمده برابر هستند، به این نتیجه قانون پایستگی جرم گفته میشود. در توضیحی جامع تر میتوان گفت که طبق قانون بقا جرم، جرم مواد اولیه با جرم محصولات برابر است و در طی واکنش شیمیایی ممکن است مواد به یکدیگر تبدیل شوند و تغییر حالت دهند، اما مجموع جرم آنها ثابت باقی میماند.
معادله سوختن چوب و ترکیب آن با گاز اکسیژن به شرح زیر است:
خاکستر+ CO2 + H2O «= چوب +O2
مثال دوم:
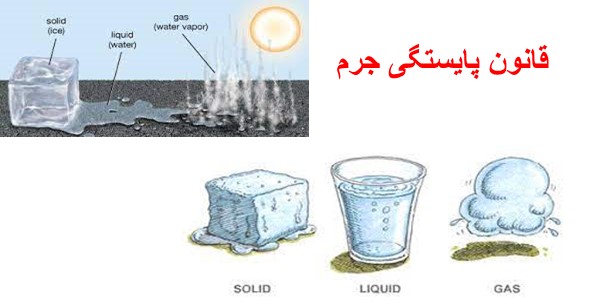
در یک تعریف دیگر تبدیل حالات مختلف ماده را داریم، به عنوان مثال هنگامی که یک تکه یخ را در محیط گرم قرار میدهیم، پس از مدتی یخ به آب تبدیل میشود اما جرم یخ اولیه با جرم آب نهایی برابرنیست!
در نگاه اول ممکن است به این تصور برسید که مقداری از یخ از بین رفته، اما این تصور اشتباه است. گرما باعث میشود که مولکولهای جامد یخ به حرکت در آیند و با ارتعاشات پیوند بین یکدیگر را سست کنند و به مولکولهای مایع تبدیل شوند. با ادامه گرما و افزایش ارتعاشات و حرکات مولکولها شاهد سستی بیشتر پیوندها خواهیم بود که نتیجه آن تبدیل مولکولهای مایع به بخار گاز است، به همین منظور هنگامی که یک تکه یخ در محیط گرم قرار میگیرد، تعدادی از مولکولهای آن به مایع تبدیل شده و تعدادی از مولکولهای مایع نیز به گاز تبدیل و از سطح مایع خارج میشوند. در نتیجه جرم آب نهایی با جرم یخ اولیه متفاوت است.
در تکمیل توضیح قانون بقای جرم این جمله را اضافه میکنیم که مواد هنگام تغییر حالت از جامد و مایع به گاز از بین نمیروند یا به وجود نمیآیند، بلکه جرم آنها ثابت بوده و تنها شکل و حالت فیزیکیشان تغییر میکند.
نکات مهم در قانون پایستگی جرم
همانطور که مطالعه نمودید، قانون بقا جرم یک قانون بسیار راحت و در عین حال پر اهمیت است. برای اجرای صحیح این قانون به یک سری نکات و موارد نیاز داریم.
محیط ایزوله
نکته اول ایزوله بودن محیط است. از آنجایی که در تبدیلات و واکنش های شیمیایی و فیزیکی، تغییر حالت ماده از جامد و مایع به گاز را داریم، گازهای تولیدی از سطح واکنش خارج شده و نمی توان جرم آنها را اندازه گرفت. به همین منظور برای صحت روابط قانون فوق، واکنش ها باید در محیط های بسته و ایزوله انجام گیرند تا به طور دقیق و درست بتوان جرم واکنش دهنده و فراورده را اندازه گیری کرد.
سیستم ایزوله به سیستمی گفته می شود که هیچگونه تعامل و واکنشی با محیط اطراف خود نداشته باشد. بدین صورت که گرما، ماده، بخار، گاز و … از این سیستم خارج نشده و عوامل بیرونی نیز بر روی آن تاثیر ندارند. هنگامی که واکنشی در یک سیستم ایزوله انجام می شود هرگونه تغییر و تبدیل در آن ثابت باقی می ماند و می توان تغییرات را اندازه گیری کرد. به همین دلیل ایزوله بودن محیط برای اثبات قانون بقا جرم بسیار مهم است و در غیر این صورت نمیتوان این قانون را به درستی اجرا و اثبات کرد.
جهان هستی نیز به عنوان یک سیستم ایزوله بسیار بزرگ در نظر گرفته میشود، به همین منظور است که طبق قانون پایستگی جرم تمامی واکنش های انجام شده در جهان با پیروی از پایستگی جرم پیش میروند و نقضی در آنها دیده نمی شود.
موازنه
مسئله مهم دیگر در صحت این قانون موازنه بودن واکنش است. در هر واکنش شیمیایی تعداد مولکولها و اتمهای به کار رفته در واکنش دهنده با تعداد مولکولها و اتمهای موجود در فراورده باید به طور موازنه و برابر قرار گیرند تا بتوان به صحت قانون بقا جرم رسید. این برابری عناصر برابری جرم را به همراه خواهد داشت، چرا که هر عنصر برای خود دارای جرم اتمی خاصی است.
به عنوان مثال در معادلهای نظیر تشکیل آب، دو مولکول از هیدروژن با یک مولکول اکسیژن ترکیب می شوند و دو مولکول آب را به وجود میآورند. یا برای واکنش هایی نظیر سوختن تعداد اتم های کربن و اکسیژن و هیدروژن در دو طرف معادله باید با یکدیگر برابر باشند و این برابری تنها در صورتی اجرا می شود که ضریب مواد به گونه ای قرار گیرند که تعداد اتم ها در مواد واکنش دهنده و محصولات یکسان شود. به این کار استوکیومتری واکنش گفته میشود که هم برای حل سوالات و هم برای بررسی قانون پایستگی جرم بسیار پر اهمیت است.
پیدایش اولیه مواد پیش از قانون بقا جرم
ممکن است پس از اطلاع از قانون فوق، این سوال برایتان ایجاد شده باشد که اگر طبق قانون بقای جرم، جرم مواد همیشه ثابت است و طی واکنشها دچار تغییر و تحول نمیشوند، پس مولکول ها و عناصر اولیه موجود در جهان از کجا پدید آمدند؟ سرآغاز جهان هستی از کجاست؟ برای پاسخ به این سوالات خوب است که توضیحی در مورد نحوه پدید آمدن اولیه عناصر و نخستین واکنشها برایتان بگوییم.
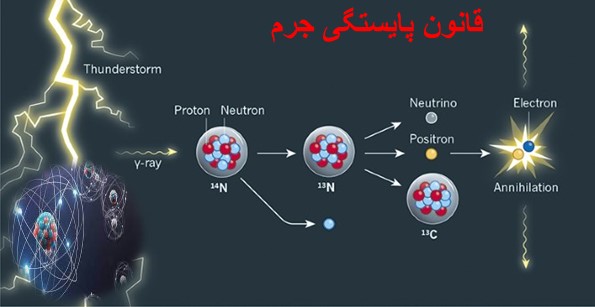
به طور کلی پیدایش جهان هستی و کیهان با یک انفجار بسیار بزرگ با نام مهبانگ همراه بود. در ادامه این انفجار، ذرههای ریز اتمی مانند الکترون، پروتون و نوترون تشکیل شدند و در مدت کوتاهی عناصر اولیه مانند هیدروژن و هلیوم نیز پدید آمدند. با گذشت زمان و کاهش دما، گازهای فوق متراکم شده و مجموعههای گازی را تشکیل دادند. در ادامه این مجموعههای گازی دچار فعل و انفعالات شدند و با تغییرات دما، عناصر دیگر نیز به وجود آمدند. این سلسله مراتب سبب شد تا کم کم تمام جهان هستی شکل گیرد و اتم ها و عناصر اولیه جهان را تشکیل دهند. فعل و انفعالات گفته شده به واکنش های هسته ای معروفت هستند که در هسته اتمها و بین ذرات ریز اتمی رخ میدهد.
واکنش های هستهای بر خلاف واکنشهای شیمیایی در پیروی از قانون بقای جرم دارای تفاوت هایی هستند. در واکنشهای شیمیایی قانون پایستگی جرم برای مجموع جرم واکنش دهندهها و فراوردهها بیان میشود، اما در واکنشهای هسته ای قانون پایستگی برای مجموعه جرم به همراه انرژی بیان می شود. بدین صورت که طی یک واکنش هسته ای مجموع جرم و انرژی واکنش دهنده با مجموع جرم و انرژی فرآورده یکسان خواهد بود. به همین دلیل است که ماده واکنش دهنده در واکنش هسته ای دچار تغییر شده و در کنار تولید یک ماده با جرم متفاوت، مقداری انرژی نیز آزاد میکند.
قانون پایستگی جرم و انرژی
پس از بررسی واکنش های هسته ای، در کنار قانون بقا جرم، قانون پایستگی انرژی نیز روی کار آمد. این قانون بیشتر در علم فیزیک مدرن مورد بررسی قرار گرفت و با توجه به روابط و فرمولهای خاص موجود در این زمینه اثبات گشت. همانطور که می دانید در تمامی واکنش های شیمیایی مقداری انرژی آزاد شده که این انرژی میتواند به صورت گرما، نور، صوت و …. باشند. این انرژی آزاد شده را نمیتوان به صورت جرم اندازه گیری کرد ،پس برای محاسبه آن به واحد انرژی نیاز داریم.
عامل اصلی در بیان قانون پایستگی انرژی، انرژی درونی سیستم و الکترون ها می اشند که سبب فعل و انفعالاتی در طول واکنش میگردند. این فعل و انفعالات ممکن است به صورت واکنش گرماگیر یا واکنش گرماده خود را نشان دهند که در هر دو صورت بقای انرژی را خواهیم داشت. پس قانون بقای انرژی به تکمیل قانون بقا جرم می پردازند و این دو قانون با هم بیانگر تعادل دائمی در جهان هستنی هستند. هیچ برهمکنشی نیست که تعادل و برابری جرم و انرژی را بر هم زند و یا قوانین گفته شده را زیر سوال برد.
کلام آخر در مورد قانون پایستگی جرم
قانون پایستگی جرم یکی از قانونهای اساسی در علم شیمیبوده که در سال ۱۷۸۹ و توسط شیمیدان آنتوان لاووازیه مطرح شد. یافتههای وی سبب تحول عظیمی در علم و نگرش به جهان گشت. این قانون بیان میکند که جرم مواد در واکنشهای شیمیایی ثابت باقی مانده و نه ماده ای به وجود میآید و نه ماده از بین میرود، بلکه تنها از حالتی به حالت دیگر تبدیل میشود. این عدم تغییر سبب پایداری در جرم کلی سیستم میگردد.
بدین صورت اگر تمام واکنش دهندهها و محصولات را طی واکنش شیمیایی یادداشت کرده و جرم هر کدام را جدا جدا اندازه گیری کنیم، به این نتیجه خواهیم رسید که جرم مواد واکنش دهنده و جرم محصولات با هم برابر خواهند بود. امروز این قانون در کتابهای درسی و علوم دانشگاهی بیان شده و از آن مساله و سوالات متنوع طرح میشود. در صورتی که شما نیز قصد یادگیری این قانون و حل سوالات مربوط به آن را دارید میتوانید از آموزشهای ویدیویی یا محتواهای مفید قرار گرفته در فرادرس کمک بگیرید. در این محتواها بهترین و برترین دبیران به توضیح قانون پایستگی جرم و آموزش آن به زبان ساده پرداختهاند.